Les mitochondries sont souvent décrites comme des bâtonnets de 0,5 Ám de diamètre et d'une longueur de plusieurs Ám. Mais la forme et la taille des mitochondries sont assez variables, ce que traduit le terme même de mitochondrie : mitos (filament) et chondros (grain). De plus, la cinématographie de cellules vivantes observée en microscopie à contraste de phase a révélé que les mitochondries changent continuellement de forme : augmentation de volume, fragmentation, fusion... C'est pourquoi le dénombrement des mitochondries d'une cellule n'a pas grande signification. Il préférable de lui substituer une mesure liée au chondriome (ensemble des mitochondries d'une cellule) : volume, ou mieux : surfaces membranaires, etc.
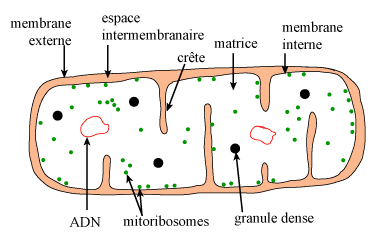
| Figure 2. Schéma d'une mitochondrie. |
 |
En dépit d'un apparent polymorphisme, la microscopie électronique révèle, quel que soit le type cellulaire ou l'état physiologique, que les mitochondries sont toujours constituées de 4 éléments : 2 membranes délimitant 2 compartiments (figure 2) :
A partir de la fraction mitochondriale purifiée obtenue par fractionnement cellulaire, il est possible d'isoler ces 4 constituants et de les étudier séparément, notamment du point de vue chimique.
La membrane externe a une épaisseur comparable à celle des autres membranes cellulaires (environ 7,5 nm), comme l'est sa composition chimique globale (lipides : 40 p 100 du poids sec, protéines : 60 p 100). Les protéines sont représentées surtout par :
L'espace intermembranaire apparaît très transparent en microscopie électronique. Sa composition en molécules de petite taille est évidemment identique à celle du cytosol. On y trouve notamment des adényl-kinases utilisant l'ATP provenant de la matrice pour phosphoryler d'autres nucléotides.
La membrane interne, comparée aux autres membranes cellulaires, est particulière à plus d'un titre, notamment par sa faible épaisseur (5-6 nm) et par sa richesse en protéines (80 p 100). En ce qui concerne les lipides, elle est caractérisée par l'absence de cholestérol et par la présence en forte proportion d'un lipide qui lui est spécifique : le diphosphatidyl-glycérol (ou cardiolipide), qui la rend particulièrement imperméable aux ions.
| Figure 3. Phosphorylation oxydative dans la membrane interne des mitochondries. |
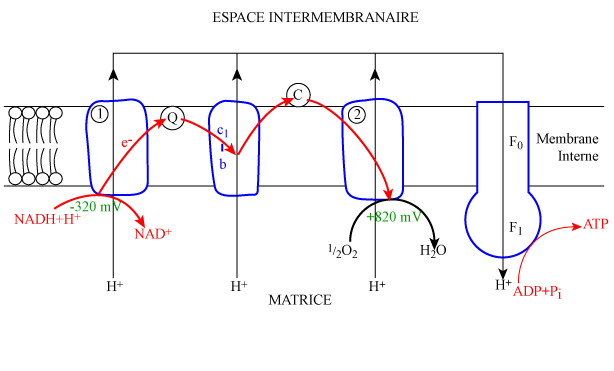 |
| légende : |
Les protéines de la membrane interne sont d'une grande diversité. Ce sont :
La matrice contient des éléments visibles en microscopie électronique
: « granules denses », ribosomes (mitoribosomes), etc.(figure 2).
Du point de vue chimique, la plus grande partie des molécules peut être
divisée en 2 catégories :
Les transporteurs d'hydrogène réduits cèdent leurs électrons aux transporteurs d'électrons de la chaîne respiratoire (figure 3). Il se produit une succession de réactions d'oxydo-réduction, chaque transporteur fonctionnant alternativement comme accepteur et donneur d'électrons. Le dernier accepteur d'électron est l'oxygène qui se combine à 2 protons pour former une molécule d'eau, ce qui est à l'origine de la vapeur d'eau expirée.
Ce transfert d'électrons le long de la chaîne est spontané puisque l'affinité pour les électrons croît progressivement du premier couple d'oxydo-réduction (NADH/NAD+) au dernier (1/2O2/H2O) avec respectivement des potentiels redox de -320 mV et + 820 mV. Ce transfert d'électrons, s'accompagne donc d'une libération d'énergie, qui se fait en 3 étapes (figure 3) et qui est utilisée pour pomper des protons de la matrice vers le compartiment intermembranaire. Ceci produit un gradient de concentration de protons et une différence de potentiel entre les deux faces de la membrane interne qui sont maintenus par la grande imperméabilité de la membrane aux ions (cardiolipide) et qui constituent « la force motrice protonique ».
L'existence de cette dernière vient à l'appui de la théorie chimiosmotique de Mitchell (1961) qui propose un mécanisme permettant d'expliquer le couplage du transfert d'électrons et de la phosphorylation de l'ADP. En effet, selon cette théorie, qui est maintenant bien étayée par de nombreux travaux expérimentaux, le couplage transfert d'électrons / phosphorylation se fait par l'intermédiaire de la force motrice protonique. Le complexe ATP synthase couple le flux de protons, qui descend le gradient de concentration, à la phosphorylation de l'ADP (figure 3). Le complexe F0 de l'ATP synthase constitue un tunnel qui est la seule voie de passage des protons vers la matrice. Les protons ainsi éjectés par la force motrice protonique entraîneraient la synthèse de l'ATP par la composante catalytique de l'ATP synthase : le complexe F1. Le processus serait le suivant : en présence d'ADP et de Pi, ce dernier catalyse spontanément la synthèse d'ATP qui reste fermement fixé au site catalytique, l'éjection des protons aurait pour effet de forcer l'ATP à se détacher du site, le laissant libre pour la synthèse d'une nouvelle molécule d'ATP.