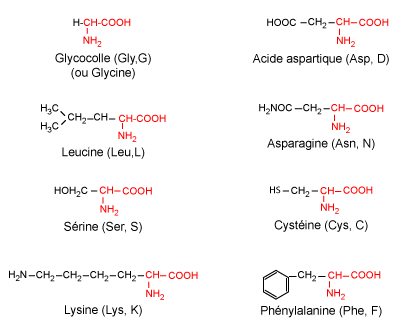
| Figure 5 : Ils sont désignés soit par un symbole à 3 lettres, ou plus récemment selon une nomenclature à une seule lettre.
|
 |
Les peptides, polypeptides et protéines sont des polymères plus ou moins longs d'acides aminés.
Les acides aminés ou amino-acides sont des molécules polycarbonées
portant une fonction acide carboxylique et une fonction amine. Dans la matière
vivante, on trouve 20 acides aminés différents, qui sont tous
des a-amino-acides, dont un carbone (Ca) est lié à 4 groupes chimiques
différents : un hydrogène, une fonction carboxyle, une fonction
amine et un radical R encore appelé chaîne latérale. Ce
carbone asymétrique est à l'origine de l'existence de deux séries
: L et D. Les
Les 20 amino-acides naturels diffèrent donc par leur chaîne latérale (figure 5). Selon les propriétés de cette dernière, ils peuvent être répartis en plusieurs groupes :
Les acides aminés hydrophiles :
Remarque : Dans une protéine, les fonctions S-H de deux cystéines
peuvent s'oxyder pour former un pont disulfure
| Figure 5 : Ils sont désignés soit par un symbole à 3 lettres, ou plus récemment selon une nomenclature à une seule lettre.
|
 |
L'enchaînement linéaire des acides aminés constitue la structure primaire des protéines. L'ordre dans lequel se succèdent les amino-acides constitue la séquence de la protéine. C'est cette séquence, qui caractérise la protéine considérée, qui est codée par le gène correspondant.
Remarque : le nombre d'acides aminés différents étant de 20, le nombre de combinaisons théoriquement possibles pour un polypeptide de 50 amino-acides est de 2050, ce qui est à la base de la diversité biologique.
La polymérisation des amino-acides se réalise par formation de liaisons peptidiques (figure 6). Un polymère de moins de 30 amino-acides est appelé peptide. Un polypeptide est constitué de 30 à 150 amino-acides ; une protéine, de plus de 150.
Dans tous les cas, le polymère présente une orientation. L'acide aminé situé à une des extrémités de la molécule possède une fonction amine non impliquée dans une liaison peptidique, c'est l'amino-acide N terminal. A l'autre extrémité, l'amino-acide C terminal présente un carboxyle libre (figure 6).
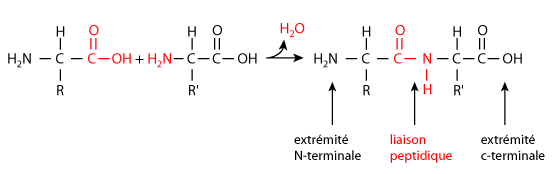 |
Figure 6 Formation d'un dipeptide |
La connaissance de la séquence, donc de la structure primaire d'une protéine ou d'un peptide ne suffit pas à rendre compte de ses propriétés. En fait, une chaîne polypeptidique présente une conformation spatiale qui est en grande partie responsable de son activité biologique.
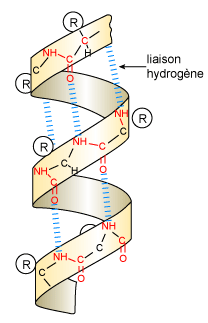
La structure secondaire est due à des configurations régulières
: hélice a, plan plissé b, maintenues par des liaisons hydrogène
entre les groupements
| Figure 7 : Hélice régulière dont le pas est de 0,54 nm, correspondant à 3,6 résidus d'amino-acides. |
 |
La structure tertiaire résulte de liaisons faibles (hydrogène, ioniques, forces de Van der Waals, interactions hydrophobes) formées entre les chaînes latérales des amino-acides, ce qui entraîne un repliement des hélices a et des feuillets b. Ce processus est à l'origine d'une conformation tridimensionnelle irrégulière, et par là même spécifique, de chaque protéine. La situation est en effet très différente de celle de la structure secondaire, qui s'établit à partir des liaisons peptidiques, lesquelles sont toutes identiques, ce qui donne des configurations régulières. Dans le cas de la structure tertiaire, les liaisons s'effectuent entre les chaînes latérales, différentes d'un acide aminé à un autre. Ce sont donc les positions de certains amino-acides dans la séquence de la chaîne polypeptidique qui conditionnent l'existence de liaisons à des endroits précis, et donc la nature nécessairement irrégulière et spécifique de la structure tertiaire (figure 8).
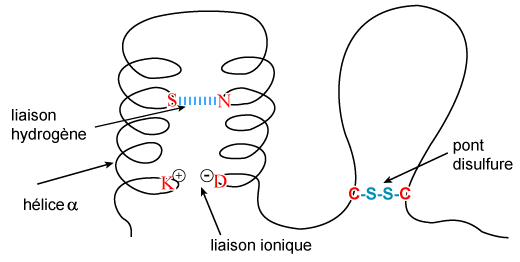
Figure 8 : Représentation schématique de la structure tertiaire des protéines.
Le repliement est dû à la formation de liaisons faibles entre les chaînes latérales de certains amino-acides, représentés ici par la lettre qui les désigne dans la nomenclature (voir figure 5). Cette conformation tridimensionnelle spécifique de la protéine peut être stabilisée par l'existence de ponts disulfures (liaisons covalentes).
Cette configuration spécifique est dite "native", elle s'établit lors de la synthèse de la protéine. Elle correspond à la configuration spatiale la plus stable, c'est-à-dire celle qui présente le minimum d'interaction avec le milieu environnant. Lorsque la protéine est en milieu aqueux, ce qui est généralement le cas, la structure tertiaire donne généralement naissance à une forme globulaire, à l'intérieur de laquelle se trouvent les groupements hydrophobes ; les groupements hydrophiles étant surtout localisés à la surface, au contact de l'eau.
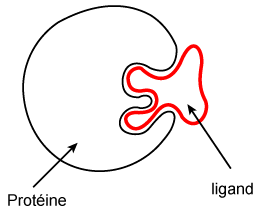
La configuration tridimensionnelle de la protéine est responsable de ses propriétés biologiques. Notamment, elle rend possible sa liaison spécifique avec une autre molécule appelée ligand. La liaison s'établit grâce à une complémentarité de forme entre les deux molécules (figure 9), assurant ainsi la spécificité de la liaison. C'est le cas de la réaction anticorps-antigène, ou encore de la liaison de certaines protéines de transport avec les molécules transportées (voir chapitre 3).
|
Figure 9 : Représentation schématique de la complémentarité spatiale spécifique entre une protéine et son ligand. |
 |
La configuration tridimensionnelle peut être détruite par rupture des liaisons hydrogène et autres liaisons entre les radicaux, sous l'effet de la chaleur par exemple. La protéine est dite "dénaturée" et elle perd ses propriétés biologiques.
Les protéines sont parfois formées de plusieurs sous unités
réunies par des liaisons faibles, ce qui constitue la structure quaternaire.
Ainsi, l'hémoglobine, par exemple, est constituée de 4 sous unités
: 2 globines a et 2 globines b
liées à un groupement prosthétique (petite molécule
non peptidique) : l'hème.
Note : Il existe des protéines dites « désordonnées
» ou « non structurées » (jusqu’à 60 p
100 des protéines cellulaires) qui ne possèdent pas de configuration
spatiale définie mais qui présentent néanmoins une activité
biologique. La manière dont s’exerce cette dernière n’est
pas encore connue.