4.1.2 Perméabilité due aux protéines
Les membranes cellulaires sont perméables aux molécules polaires qui ne traversent
que très lentement les doubles couches lipidiques artificielles. Le transport
de ces molécules est assuré par des protéines membranaires : les protéines
porteuses ou protéines de transport.
Ces protéines sont spécifiques, c’est à dire qu’une protéine donnée n’assure
que le transport d’une classe de composés chimiques, voire d'une molécule particulière.
Il existe plusieurs catégories de protéines de transport.
a) Canaux protéiques
Ils sont également appelés tunnels protéiques (tunnels ou canaux ioniques),
ou conductines.
Les protéines de ce type forment des canaux aqueux qui permettent aux solutés
de traverser la membrane dans le sens du gradient de concentration. Il s’agit
de diffusion simple
(Animation 1: 2ème étape).
b) Transporteurs vrais
Ce sont des protéines qui se lient spécifiquement à la molécule transportée
(liaison protéine-ligand).
On distingue :
Les uniporteurs :
La molécule transportée traverse plus rapidement la membrane que dans le cas
de la diffusion simple : on parle de diffusion facilitée. Le sens du transport
ne dépend que du gradient de concentration, il s'agit encore de transport passif
(Animation 1: 3ème étape). Mais ici, la vitesse
de transport augmente d’abord très rapidement en fonction de la concentration
du soluté puis atteint un plateau qui correspond à la saturation des transporteurs
(figure 11). Ce type de transport implique vraisemblablement un changement de
configuration de la protéine de transport : la transconformation (figure
13) (exemple : la perméase au glucose de la membrane des hématies).
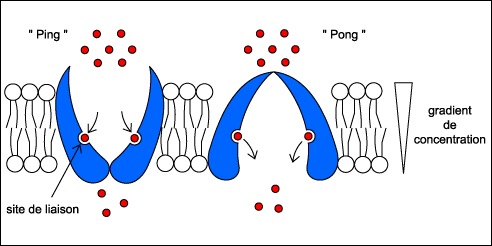
Le transporteur possède un site de liaison, spécifique
de la molécule transportée. La formation du complexe transporteur-ligand
induit un changement de forme du transporteur dont une représentation
schématique est donnée ici. Ce changement de forme permet
la translocation du complexe à travers la double couche lipidique.
Le complexe se dissocie alors sur l'autre face de la membrane.
|
 |
Les cotransporteurs :
Ils présentent les caractéristiques générales des uniporteurs mais permettent
le transport de molécules contre leur gradient de concentration. Ce type de
transport est dit "actif", il nécessite une dépense d'énergie. Le
transport de la molécule contre son gradient de concentration est couplé à celui
d’une autre molécule (dite molécule co-transportée, souvent un ion) qui, elle,
se déplace dans le sens de son propre gradient. C'est le gradient ionique de
la molécule co-transportée qui fournit l'énergie. Remarquons que l'existence
de ce gradient est due à l'activité d'un transporteur utilisant l'énergie de
l'ATP (voir le paragraphe suivant). Le gradient ionique constitue alors une
forme de stockage de l'énergie. Pour cette raison, le transport par cotransporteur
est parfois qualifié de transport actif secondaire.
- Symport : les deux molécules traversent la membrane dans le même sens
(exemple : le symporteur glucose-Na+ des entérocytes).
(Animation 1: 4ème étape)
- Antiport : les deux molécules sont transportées en sens inverses (exemple :
l'échangeur Na+-Ca2+).
(Animation 1: 5ème étape)
c) Pompes mues par l’ATP
Certaines protéines de transport font passer les molécules à travers la membrane
contre leur gradient de concentration en utilisant directement l’énergie restituée
par l’hydrolyse de l’ATP. Il s'agit de transport actif primaire
(Animation 1 : 6ème étape).
L'exemple le plus connu est celui de la pompe Na+ - K+.
Le maintien du potentiel de membrane (ou "potentiel de repos") de
la cellule est lié à l’existence d’une forte concentration de K+
et à une faible concentration de Na+ dans le cytosol. Le potentiel
de membrane résulte du fonctionnement de deux protéines de transport. Le canal
de fuite du K+ est un canal protéique par lequel s’écoule le K+
par diffusion simple, mais aussi dans une plus faible mesure le Na+.
Ceci aboutirait à une égalisation des concentrations des ions Na+ et
K+ de part et d’autre de la membrane plasmique si n’était la pompe
Na+ - K+ qui véhicule ces deux ions contre leurs gradients
de concentration.
Ce transporteur est un tétramère constitué d’une protéine a
de 120.000 Da et d’une glycoprotéine ß de 55.000 Da, chacune en deux exemplaires.
Le protomère b joue seulement un rôle de maintien
de la conformation spatiale du protomère a. Ce dernier
possède à la fois les sites de liaison du Na+ et du K+
ainsi que le site de fixation de l’ATP (site catalytique) qui permet au transporteur
d’agir comme une ATPase. Le groupement phosphate terminal de l’ATP est transféré,
en présence de Na+, au transporteur qui est ainsi phosphorylé. Ce
phosphate est ensuite hydrolysé en présence de K+, le transporteur
se trouve alors sous forme déphosphorylé. Ces phosphorylations et déphosphorylations
réversibles induisent des changements de configuration spatiale de la protéine
(transconformation) qui permettent le transport des ions.
